Табун (хімічная зброя)
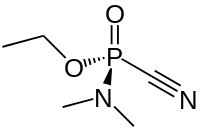
Табу́н[1] (этылавы эфір дыметыламіда цыянафосфарнай кіслаты) — фосфарарганічнае злучэнне. Атрутнае рэчыва нервова-паралітычнага дзеяння. Выклікае моцны міёз.
| Табун (хімічная зброя) | |
| |
| Агульныя | |
|---|---|
| Хім. формула | C₅H₁₁N₂O₂P |
| Тэрмічныя ўласцівасці | |
| Класіфікацыя | |
| Рэг. нумар CAS | |
| PubChem | |
| SMILES | |
| ChemSpider | |


Бясколерная рухомая вадкасць тэмпература кіпення 220 (240[2][1], каля 230[3]) °C, тэмпература плаўлення −50[1][3] (−48[2]) °C. Шчыльнасць 1077,8 кг/м³[1] (1087 г/см³[3]). Дрэнна раствараецца ў вадзе (каля 12 %), добра ў арганічных растваральніках.
Сінтэз і ўласцівасці правіць
Табун атрымоўваюць паслядоўным узаемадзеяннем хлорвокісу фосфара POCl3 са злішкам дыметыламіна, потым з этанолам і цыянідам калію:
- POCl3 + 2(CH3)2NH (CH3)2NP(O)Cl2 + (CH3)2NH•HCl
- (CH3)2NP(O)Cl2 + C2H5OH (CH3)2NP(O)ClOC2H5 + HCl
- (CH3)2NP(O)ClOC2H5 + KCN (CH3)2NP(O)(CN)OC2H5 + KCl
Упершыню атрымаў нямецкі хімік Герхард Шрадэр.
Павольна гідралізуецца вадой, у кіслым асяроддзі гідроліз паскараецца, пры гэтым адбываецца адўчапленне дыэтыламіднай групы:
- (CH3)2NP(O)(CN)OC2H5 + H2O + HCl (CH3)2NH•HCl + HOP(O)(CN)OC2H5
Хутка гідралізуецца ў растворах шчолачаў, адшчапляе цыянід-іён:
- (CH3)2NP(O)(CN)OC2H5 + NaOH (CH3)2NP(O)(OH)OC2H5 + NaCN
Лёгка ўзаемадзейнічае з растворамі аміяку і амінаў, што выкарыстоўваецца для дэгазацыі табуна. Прадукты дэгазацыі з’яўляюцца ядавітымі, бо ўтрымоўваюць солі сінільнай кіслаты.
Гл. таксама правіць
Зноскі правіць
Літаратура правіць
- Таб́ун, дыметыламід этылавага эфіру цыянафосварнай кіслаты // Беларуская энцыклапедыя: У 18 т. Т. 15: Следавікі — Трыо / Рэдкал.: Г. П. Пашкоў і інш. — Мн. : БелЭн, 2002. — Т. 15. — С. 368—369. — 10 000 экз. — ISBN 985-11-0035-8. — ISBN 985-11-0251-2 (т. 15).
- Табу́н // Т. 25. Струнино — Тихорецк. — М. : Советская энциклопедия, 1976. — С. 163. — (Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров; 1969—1978). (руск.)
- Табу́н // Военный энциклопедический словарь / Отв. ред. Еремина Н.. — М.: Эксмо, 2007. — С. 896. — 1024 с. — 5 000 экз. — ISBN 978-5-699-23223-9. (руск.)