Хімічнае злучэнне
Хімічнае злучэнне — складанае рэчыва, якое складаецца з хімічна звязаных атамаў двух або некалькіх элементаў. Некаторыя простыя рэчывы таксама могуць разглядацца як хімічныя злучэнні, калі іх малекулы складаюцца з атамаў, злучаных кавалентнай сувяззю (азот, кісларод, ёд, бром, хлор, фтор, меркавана астат). Склад хімічнага злучэння запісваецца ў выглядзе хімічных формул, а будова часта паказваецца структурнымі формуламі.
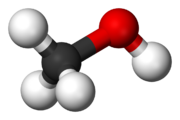
Звычайна, структурнай адзінкай хімічнага злучэння з'яўляецца малекула, хімічны склад і будова якой можа вызначацца пэўнай хімічнай формулай. Аднак, у цвёрдацельным стане хімічныя сувязі паміж атамамі розных хімічных элементаў перабудоўваюцца, і, нягледзячы на тое, што цвёрдацельнае рэчыва мае аднолькавы хімічны склад са сваёй газападобнай формай, асобныя малекулы ў ёй не захоўваюцца.
У пераважнай большасці выпадкаў хімічныя злучэнні падпарадкоўваецца закону пастаянства складу і закону кратных адносін. Аднак вядомыя даволі шматлікія злучэнні пераменнага складу (берталіды), напрыклад:
Хімічныя злучэнні атрымліваюць у выніку хімічных рэакцый. Складаныя рэчывы могуць раскладацца з утварэннем некалькіх іншых рэчываў. Утварэнне хімічных злучэнняў суправаджаецца вылучэннем (экзатэрмічная рэакцыя) або паглынаннем (эндатэрмічная рэакцыя) энергіі. фізічныя і хімічныя ўласцівасці хімічных злучэнняў адрозніваюцца ад уласцівасцей рэчываў, з якіх яны атрыманы. Хімічныя злучэнні падзяляюцца на неарганічныя і арганічныя. Вядома больш за 100 тыс. неарганічных і больш 3 млн. арганічных злучэнняў. Кожнае хімічнае злучэнне, якое апісана ў літаратуры, мае ўнікальны ідэнтыфікатар — CAS-нумар.
Злучэнне можа быць такім, як вада, калі сувязь утрымліваецца дзякуючы агульнай пары электронаў, гэта значыць існуе кавалентная сувязь, або іоннай, калі сувязь утвараецца дзякуючы прыцягненню процілеглых зарадаў, як хларыд натрыю. Злучэнні могуць мець розныя фізічныя станы, яны могуць быць у цвёрдым стане, вадкасцю, газам або плазмай. Яны могуць распадацца да меншых злучэнняў або да атамаў пры пэўных тэмпературах.
Складаныя рэчывы:
Гл. таксама
правіцьСпасылкі
правіць- На Вікісховішчы ёсць медыяфайлы па тэме Хімічнае злучэнне
- Пералік хімічных злучэнняў Архівавана 12 ліпеня 2010. (руск.)
Артыкул вымагае праверкі арфаграфіі Удзельнік, які паставіў шаблон, не пакінуў тлумачэнняў. |